Вдохновляющие результаты научного проекта, реализованного при поддержке Российского научного фонда (РНФ), а также усилиями специалистов Института молекулярной биологии имени В.А. Энгельгардта РАН и Московского государственного университета имени М.В. Ломоносова, открывают новые горизонты в понимании процессов программируемой гибели клеток и их роли в восстановлении тканей организма. Это открытие уже привлекло широкое внимание научного сообщества.
Природная мудрость: как организм поддерживает здоровье
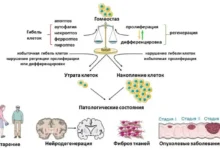
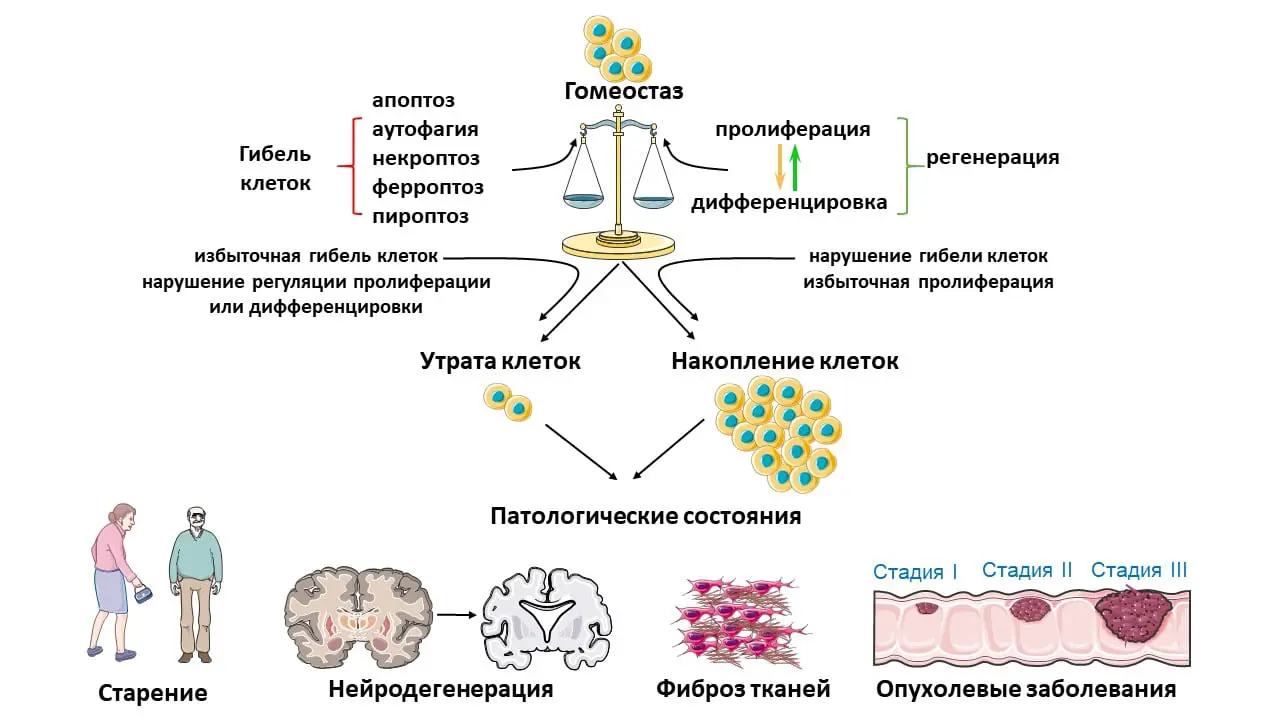
Каждый день в человеческом организме естественным образом исчезает огромное количество клеток. Такая замена построена на принципах точного контроля и баланса. Процессы программируемой клеточной гибели обеспечивают регулярное обновление клеток, поддерживают омоложение тканей и защищают нас от скопления устаревших, поврежденных или потенциально опасных для здоровья клеток. Благодаря такой тонко настроенной системе наш организм избавляется от тех элементов, которые уже выполнили свои задачи, предотвращая возникновение различного рода нарушений.
Именно это равновесие между делением, созреванием и утилизацией клеток позволяет нам ежедневно наслаждаться энергией жизни. Если этот идеальный баланс оказывается нарушенным, возможны серьезные сбои, приводящие к таким проблемам, как опухолевые заболевания, неконтролируемое разрастание соединительной ткани (фиброз), нейродегенеративные процессы и многие другие патологии.
Множественные пути судьбы клетки: апоптоз, некроз и ферроптоз
В ходе масштабного анализа научных публикаций российскими учеными были изучены и обобщены сведения о разнообразии форм программируемой гибели клеток. На сегодняшний день науке известно более десяти различных сценариев, по которым происходит этот сложный процесс. Исследования позволили проследить взаимосвязь между механизмами гибели клеток и восстановительными способностями организма.
Наиболее хорошо изученной формой считается апоптоз — детально запрограммированный гибельный путь, при котором клетка рассыпается на относительно небольшие частицы, окруженные мембраной. Такие «апоптотические тельца» эффективно захватываются макрофагами, специальными клетками иммунной системы, очищающими ткани от содержащихся в них отмерших клеток. Важной особенностью апоптоза является его «мягкое» течение: этот процесс не запускает воспалительных реакций, благодаря чему поврежденные ткани быстрее восстанавливаются.
Для сравнения, некроз — это другой сценарий гибели, при котором содержимое разрушающейся клетки становится доступно окружающей ткани, вызывая воспаление. Такой путь не контролируется организмом в полной мере и часто связан с экстремальными или патологическими условиями, в результате которых погибают большие участки ткани.
Еще один значимый путь — ферроптоз, которому ученые уделяют особое внимание. Он инициируется специфическим окислением фосфолипидов мембран при участии ионов железа. Это приводит к накоплению активных форм кислорода — агрессивных молекул, оказывающих повреждающее воздействие на мембраны, ДНК, белки и другие важнейшие компоненты клетки. «Изучение механизмов ферроптоза позволяет понять, как именно организм регулирует свою клеточную численность и восстанавливает ткани в условиях различных стрессов», — отмечает руководитель исследования, доктор биологических наук Гелина Копеина.
От научных гипотез к практическим методам борьбы с болезнями
Все типы запрограммированной гибели клеток — это не просто научный интерес, но и фундамент для разработки современных подходов в терапии ряда заболеваний. Как показала работа коллектива под руководством Гелины Копеиной и Анастасии Ефименко, воздействие на механизмы клеточной гибели открывает возможности для смягчения течения, а иногда и для предотвращения многих опаснейших недугов.
Восстановление баланса между клеточной гибелью и воспроизводством критически важно, например, при лечении онкологических заболеваний, борьбе с фиброзом или торможении процессов, связанных со старением и дегенерацией нервной ткани. Чем лучше специалисты понимают запутанную сеть клеточных сигналов, тем эффективнее они могут управлять этими процессами в интересах здоровья пациента.
Российская наука движется вперед: синтез лабораторных открытий и внедрение в медицину
Комплексный труд исследовательских групп из ведущих российских научных центров — Института молекулярной биологии имени В.А. Энгельгардта РАН и Московского государственного университета имени М.В. Ломоносова — служит ярким доказательством эффективности синергии междисциплинарных усилий. Такие научные успехи вдохновляют на дальнейшую работу и укрепляют веру в то, что многие диагнозы в будущем перестанут быть фатальными благодаря глубокому пониманию механизмов, заложенных в природе самой жизни.
Именно благодаря поддержке Российского научного фонда, а также вкладу выдающихся ученых, как Гелина Копеина и Анастасия Ефименко, отечественная наука создает интеллектуальный фундамент для новых лекарств и методов диагностики, которые способны значительно повысить качество и продолжительность жизни людей во всем мире.
Перспективы: новые горизонты в медицине благодаря пониманию клеточных процессов
Углубленное изучение механизмов клеточной гибели не только продвигает фундаментальную биологию, но и способствует разработке инновационных методов терапии и профилактики сложнейших заболеваний. Результаты работы российских ученых уже вызывают рост интереса во всем мире и закладывают основу для развития передовых подходов в медицинской практике будущего.
Современные научные исследования позволили значительно продвинуться в понимании того, каким образом разные пути клеточной гибели влияют на процессы восстановления тканей. Оказалось, что каждый из сценариев смерти клетки уникально взаимодействует с окружающей средой, воздействует на регенерацию и поддерживает здоровое функционирование организма.
Апоптоз: природа как строитель
Апоптоз — это тщательно регулируемый процесс, который можно назвать «гигиеничной» гибелью клетки. В ходе апоптоза клетка формирует крошечные пузырьки, называемые везикулами ApoEVs. Внутри этих структур содержится ценный «груз» — ДНК, РНК, белки и lipиды. Примечательно, что появление таких везикул становится мощным сигналом для соседних клеток к активизации процессов роста и деления. Таким образом, организм способен быстро восполнить необходимое количество клеток без потери функциональности ткани.
Эксперименты, проведенные на лабораторных грызунах, убедительно показали: специальные препараты, содержащие ApoEVs, ускоряют заживление повреждений кожи почти на половину — примерно на 40%. Это открывает новые горизонты для разработки эффективных методов регенеративной терапии.
Некроз тоже важен: воспаление во благо
Несмотря на то, что некроз часто считается менее «упорядоченным» и может ассоциироваться с воспалением, ученые доказали его возможную пользу. При некрозе клетки выбрасывают в окружающую среду сигнальные молекулы DAMPs, которые не остаются без внимания иммунной системы. На этот зов откликаются макрофаги, выполняющие двойную функцию: они очищают поврежденную ткань от остатков погибших клеток и одновременно инициируют активацию стволовых клеток.
Именно под воздействием макрофагов в поврежденной зоне начинается не только очищение, но и запуск процессов обновления тканей — это особенно важно для восстановления структуры нервных клеток и их оболочек. Эксперименты на мышах убедительно показали: некроз может быть незаменимым этапом для восстановления изолирующих оболочек нервных волокон в головном мозге, способствуя нормализации работы центральной нервной системы.
Риски и новые перспективы: двоякая роль клеточного умирания
Однако при всей своей пользы апоптоз и некроз могут проявлять и обратную сторону, особенно в контексте онкологических процессов. В злокачественных тканях механизмы, активирующие регенерацию и размножение, используются в корыстных целях клетками опухоли. Это может привести к ускоренному росту новообразований и повысить вероятность рецидивов — ведь опухолевые клетки буквально перехватывают «здоровые» программы, предназначенные для восстановления собственных повреждений. Поэтому влияние на механизмы клеточной гибели следует контролировать максимально аккуратно, учитывая индивидуальные особенности пациента и тип заболевания.
Стволовые клетки: секрет выживания и надежды
Не менее поразительно ведут себя стволовые клетки — настоящие защитники стабильности нашего организма. Благодаря активной выработке специальных белков, препятствующих апоптозу, и развитым системам восстановления ДНК, данные клетки способны успешно противостоять программируемой гибели. Это критически важно для сохранения клеточного запаса, который, по необходимости, пополняет ряды функционирующих клеточных «соседей» и поддерживает нормальную работу тканей.
Однако биология стволовых клеток еще не до конца раскрыла все свои тайны. Некоторые их типы проявляют повышенную чувствительность к специфическим видам клеточной гибели. На данный момент ученые продолжают изучать эти особенности, ведь понимание данных процессов может открыть уникальные подходы к лечению заболеваний и совершенствованию техник регенерации.
В итоге современные достижения позволяют с оптимизмом смотреть в будущее медицины: управление типами клеточной гибели и их взаимодействием с тканями позволит создавать более безопасные, эффективные и индивидуализированные методы лечения. Такой научный прогресс вдохновляет и дает надежду на обновление здоровья и качественную жизнь каждому человеку.
Современные исследования в области клеточной биологии свидетельствуют о том, что гибель клеток — это не простое завершение их существования, а тонко регулируемый и многоуровневый процесс. Он может не только замедлить восстановление тканей, но и, напротив, способствовать их регенерации, создавая условия для обновления организма. Учёные уверены: чтобы улучшить методы лечения возрастных изменений и быстрее справляться с последствиями травм, крайне важно понимать, как разные виды клеточной гибели запускаются и какой вклад они вносят в общее состояние организма.
Клеточная гибель: путь к регенерации
Сегодня специалисты располагают многочисленными экспериментальными данными, подтверждающими, что судьба каждой клетки в организме подчиняется специальным программам. Эти внутренние механизмы могут быть активированы в ответ на разные сигналы и провоцировать различные формы гибели клеток, каждая из которых несёт уникальные биологические последствия. Глубокое понимание этих процессов открывает новые возможности для медицины: появляется шанс разрабатывать инновационные стратегии, направленные на эффективное восстановление тканей, замедление процессов старения и повышение общего качества жизни.
Анастасия Ефименко, доктор медицинских наук, руководитель лаборатории репарации и регенерации тканей Центра регенеративной медицины МНОИ МГУ имени М.В. Ломоносова, рассказывает, что работа её команды нацелена на исследование тонких балансов между процессами деления и программируемой гибели клеток. По её словам, планируется не только глубже изучить существующие закономерности, но и разработать подходы к управлению этими процессами, чтобы стимулировать восстановление органов и тканей у организмов разного возраста. Это приблизит ученых к созданию эффективных терапевтических методик будущего, которые будут способствовать оздоровлению и долголетию.
Новые горизонты для медицины
Перспективы развития данной области науки чрезвычайно вдохновляют. Уже сейчас команда проводит исследования на различных животных моделях, чтобы понять, как можно влиять на соотношение меж делением и смертью клеток для максимального запуска регенерации. В будущем это позволит активировать потенциал организма к самообновлению и сформировать прорывные методы терапии травм и хронических заболеваний, связанных с возрастными изменениями. Таким образом, детальное изучение механизмов клеточной гибели выступает основой для настоящей медицины завтрашнего дня и, возможно, поможет каждому человеку получить шанс на долгую и активную жизнь.
Источник: naked-science.ru